Inledning
Destillering (lat. destillatio = droppa ned) kallas den process då
man värmer upp en vätska till kokpunkten, samlar ihop ångorna
och kondenserar dem till vätska. Detta brukar utföras i en destillationsapparat.
En destillering är egentligen en reningsprocess där man separerar olika vätskor med olika ångtryck.
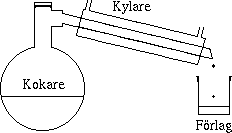
Destillationsapparaten består i princip av ett kokärl, en anordning
för att samla ihop ångan, en kylare och ett förlag, behållaren
som samlar upp den kondenserade vätskan.

Vätskan som skall destilleras placeras i kokaren och värms. Då lösningen kokar bildas ånga som leds vidare till kylaren där ångan kondenseras till vätska. Vätskan som kommer ut ur destillationen kallas destillat. Destillation används inte bara vid spritframställning utan den har många användningsområden inom kemisk-teknisk industri. I oljeindustrin används fraktionerad destillation för att separera de olika komponenterna i olja, såsom gas, bensin, smörjolja osv. De långa höga tornen som man kan se vid oljeraffinaderier är destillationskolonner.
Historia
Den äldsta beskrivningen på något som kan liknas vid en
destillation gjordes av den romerske skriftställaren Plinius. Han beskrev
en process där man kokade harts i en kittel som var täckt med filtar.
Efter kokningen vred man ur filtarna och fick sedan en olja som varit i hartsen.
Trots detta verkar destillationskonsten vara äldre än så.
Tyvärr går uppgifterna i sär om vilka som varit först
med att destillera men äran brukar tillskrivas araberna, egyptierna
eller kineserna, dock handlade det inte om spritdestillering utan om destillering
av örter och blomblad till parfym. Araberna hade i alla fall en stor
roll i spridandet av destillationskonsten eftersom de behärskade stora
delar av Sydeuropa, Nordafrika och Asien. Arabernas inflytande i destilleringskonsten
är uppenbar. Orden alkohol och alambic är ord som kommer från
arabiskan.
Äran att ha skapat den första utrustningen för vindestillering
brukar tillskrivas den franske medicinprofessorn Arnault de Villeneuve (1240-1313).
Det var även han som myntade ordet eau-de-vie. En av Villeneuves lärlingar,
Raymundus Lullius (1235-1315), upptäckte att man kunde destillera destillatet
flera gånger och på så sätt erhålla en ännu
starkare dryck.
Teori bakom destillering
Den populärvetenskapliga teorin bakom destillering säger att man
separerar vätskor med olika kokpunkt eftersom "den vätska
med lägst kokpunkt börjar koka innan den vätska med högre
kokpunkt". Som exempel brukar man även ange etanol som har kokpunkt
78°C och vatten som har kokpunkt 100°C. "Eftersom etanol har
lägre kokpunkt så kokar den bort först", brukar det heta. Denna förklaring
är inte korrekt.
För att förklara destillering måste vi införa en ny
egenskap för vätskor, ångtryck.
Ångtryck
Alla vätskor och fasta ämnen utsätts för ett tryck
av sin egen ånga. Trycket bildas ur avdunstningen av ämnet
och kallas ångtrycket (eng. vapor eller vapour pressure) för
ämnet. En vätskas ångtryck är också ett mått
på dess flyktighet. Vatten har vid 19°C ett ångtryck på
16,5 mmHg och etanol har vid samma temperatur ett ångtyck på
40 mmHg. Eftersom etanols ångtryck är högre än vattens ångtryck vid samma
temperatur, säger man att etanol är flyktigare än vatten. Ångtrycket
för en vätska beror på (1) vilket
ämne det är och (2) temperaturen på vätskan. Värms
ett ämne så mycket att dess ångtyck blir lika stort som
omgivningens tryck (101,3 kPa, 1 atm, 760mmHg, 1013mBar) börjar ämnet
att koka.
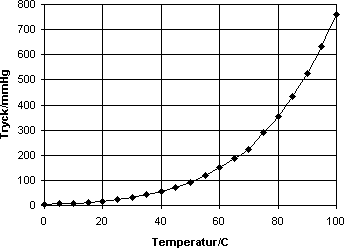
I diagrammet är vattens ångtryck ritat som en funktion av temperaturen. Man ser att ångtrycket stiger ganska snabbt med temperaturen. Vid 100°C är ångtrycket 760mmHg, d v s lika med normalt atmosfärstryck. Rent allmänt säger man att vatten har en kokpunkt vid 100°C. Skulle man halvera atmosfärstrycket till 380 mmHg ser man att vatten kokar vid ca 82-83°C. Sänks omgivningens tryck ytterligare får vatten en ännu lägre kokpunkt.
Ångtryck i lösningar
Blandar man två eller flera ämnen som är lösliga i varandra
så kommer ångtrycket för ämnet i lösning vara
beroende av ångtrycket för ämnet i ren form och hur stor
del av ämnet som finns i lösningen. Rent matematiskt
beskrivs detta av Raoults lag (efter den franske kemisten François Marie Raoult, 1830-1901):
pA i lösning = XA · pA rent
Där pA i lösning är ångtrycket av ämnet A i lösningen, XA är koncentrationen (här uttryckt i molfraktion) av ämnet A i lösningen och pA rent ångtrycket av ämnet A i ren form.
Ångtrycket för hela lösningen kommer att vara lika med summan av alla lösningsångtrycken för de ingående ämnena:
ptotal = pA i lösning + pB i lösning + pC i lösning + ...
Exempel:
En etanol och vattenlösning som innehåller 12 vol.% etanol har
sammansättningen XEtanol = 0,042 och XVatten = 0,958. Vid 19°C
är lösningens totala ångtryck:
ptotal = pEtanol + pVatten = XEtanol · pEtanol rent + XVatten · pVatten rent =
0,042 · 40 mmHg + 0,958 · 16,5 mmHg = 17,49 mmHg.
Så i lösning kan man inte skilja mellan de olika ingående
vätskorna. Är det blandat så är det blandat. Man måste
se den nya lösningen som en helt ny vätska, inte som en vätska
bestående av olika delar. Eftersom den nya vätskan kommer att
ha ett nytt ångtryck kommer den nya vätskan även att ha en
annan kokpunkt. Det är därför "den populärvetenskapliga
destillationsteorin" är felaktig. I en etanol vattenblandning kokar
inte etanolen bort först vid 78°C, utan hela lösningen
kommer att koka vid en punkt som ligger någonstans mellan 78 och 100°C.
Däremot kommer ångan att ha en annan sammansättning än
lösningen. Molfraktionen av det ämne med högst ångtryck
är (nästan) alltid högre i ångan över en lösning
än i själva lösningen. I exemplet ovan kommer etanolkoncentrationen
vara högre i ångan ovanför vätskan än i själva vätskan. Samlar man i hop ångan och kondenserar
den kommer den nya vätskan att ha samma sammansättning som ångan,
d v s en högre molfraktion av det ämne med högst ångtryck.
Ångan över en etanol/vattenlösning på 10% kommer att bestå av ca 20% etanol och 80% vatten. Samlas den ångan in och kondenseras får man en ny lösning med sammansättningen 20% etanol, och detta är kärnan i destilleringen.
Fasdiagram
Om man ritar temperaturen som en funktion gasfas- och vätskesammansättningen
får man ett fasdiagram eller, mer specifikt, ett kokpunktsdiagram.
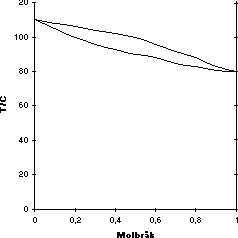
Kokpunktsdiagrammet ovan beskriver (vid atmosfärstryck) de kemiskt sett mycket lika ämnena toluen och bensen. Bensen har högre ångtryck än toluen och har därför lägre kokpunkt (80,1°C) än toluen (110,6°C). X-axeln anger lösningens respektive ångans sammansättning i molbråk. Längst till vänster på x-axeln består lösningen endast av toluen och andelen toluen minskar då man går åt höger på x-axeln. Längst till höger på x-axeln består lösningen endast av bensen och denna andel minskar då man går från höger till vänster. Väljer man 0,2 punkten till vänster på x-axeln så består lösningen av 0,2 toluen och 0,8 bensen. Y-axlarna motsvaras av temperaturen och på vänster y-axel är toluens kokpunkt utmarkerad och på höger y-axel är bensens kokpunkt utmarkerad. Mellan de båda kokpunkterna är två linjer dragna. Den undre linjen kallas vätskekurva. Temperaturen under den linjen är så låg att hela systemet befinner sig i vätskefas. Den övre linjen kallas gaskurva. Temperaturen över den linjen är så hög att hela systemet befinner sig i gasfas. Området mellan linjerna finns lösningen i både vätskefas och gasfas. Detta område kallas även tvåfasområde.
Destillering
Om man skulle destillera en lösning med molfraktionen 0,2 toluen så
följer man 0,2 på x-axeln uppåt tills man kommer till vätskekurvan.
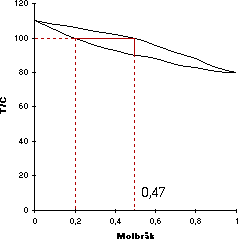
Läser man av temperaturen på y-axeln får man kokpunkten för vätskan med den aktuella sammansättningen. Går man däremot till höger vid punkten kommer man så småningom att möta gaskurvan. Läser man av på x-axeln under skärningspunkten så ser man att gasfasen kommer att ha en annan sammansättning. Gasen innehåller mer (x=0,47) av det ämne med lägst ångtryck (bensen) och detta är själva kärnan i destilleringen. Samlar man i hop ångan och kondenserar den kommer den nya vätskan att ha sammansättningen x=0,47, dvs vi har erhållit mer av den vätska med lägst ångtryck (kokpunkt).
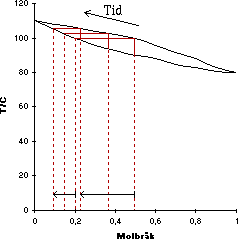
Låter man destillationen fortgå kommer efterhand lösningens
sammansättning att ändras. Eftersom det lättflyktiga ämnet
(bensen) försvinner kommer vätskesammansättningen att ändras
(förskjutas åt vänster). Detta resulterar i att gassammansättningen
också ändras (förskjuts åt vänster). Destillerar
man över all lösning så kommer destillatet att ha samma
sammansättning som den ursprungliga lösningen. Vill man ha någorlunda
separering måste destillationen avbrytas innan all lösning kokat
över. Det är naturligtvis helt meningslöst att koka över
all lösning eftersom man inte uppnått något med hela förfarandet.
Dessutom är det ett rent energislöseri.
Destillerar man destillatet igen så erhålles ännu en anrikning
av det lättflyktiga ämnet.
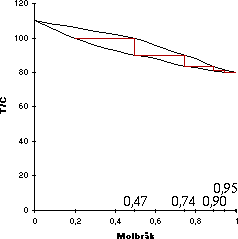
I diagrammet har man fått en vätska med samma sammansättning som gasen. Destilleras den nya vätskan går man till höger i diagrammet tills man möter gaslinjen igen. Den nya kondenserade gasen kommer att ha sammansättningen x=0,74 efter den andra destillationen. Destilleras den nya vätskan igen får man en ny vätska med sammansättningen x=0,90 o s v. Ur diagrammet så ser man att man kan få ett destillat med sammansättningen x=0,95 efter 4 destilleringar.
Kolonndestillering
I stället för att samla ihop destillat och destillera igen om och
om igen kan man utföra destillationen i en kolonnapparat.
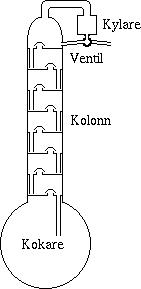
Bilden visar en typisk kolonnapparat med flera bottnar. Varje botten består
av en platta med hål som dels kan släppa igenom ånga och
låta vätska som bildats rinna ned till föregående botten.
Kolonnen behöver inte bestå av de bottnar som visas i skissen, utan den kan även vara fylld
med en kolonnfylling, bestående av t ex glaskulor eller porslinsringar. Principen blir den samma.
I en destillationskolonn eller kolonnapparat sker de upprepade destillationerna
i en process. Lösningen som skall destilleras hälls ned i kokaren
och värms. Dä vätskan kokar bildas ånga som leds uppåt
i kolonnen. Då ångan når den första bottnen kondenseras
den till vätska. Då mer ånga når bottnen värms
den nykondenserade vätskan upp igen och fortsätter sin färd
upp till nästa botten där hela processen återupprepas igen.
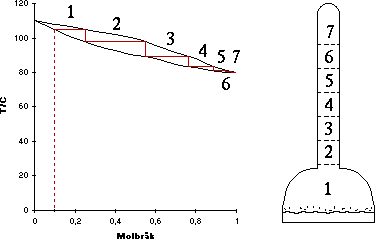
I en kolonnapparat sker alltså en massa små destillationer längs hela kolonnens höjd och man kan därför få ett mycket rent destillat med en kolonnapparat.
Destillation av etanol-vatten
I bensen-toluen systemet ovan var de ingående ämnenas kemiska
egenskaper ganska lika men i systemet etanol-vatten är det påtagliga
skillnader mellan ämnena. Detta kan resultera i en hel del konstigheter
vid destillation.
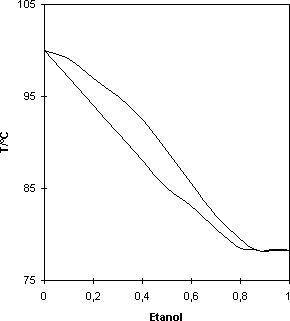
Ur kokpunktsdiagrammet för etanol-vatten ser man att det finns ett kokpunktsminimum vid x=0,89. Detta innebär att man inte kan destillera en etanol-vattenlösning till x=1,00 oavsett hur många gånger man destillerar. När lösningen når x=0,89 kommer långan och vätskan att ha samma sammansättning så vidare destillering blir helt meningslös. (Molbråket x=0,89 motsvarar 95,6 vol.% etanol.) Man säger att etanol och vatten bildar en azeotrop vid x=0,89 (95,6vol.%).
Olika typer destillationsapparater
Retort
Retorten är den enklaste av alla destillationsinstrument.
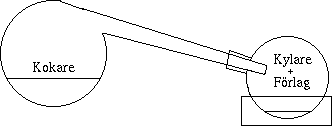
Den består av ett kärl med en lång böjd hals som leds ner i en kolv (förlaget) som i sin tur är nedsänkt i kallt vatten eller snö. De är vanligtvis gjorda av glas och används uteslutande i laboratorium för småskalig destillation. När vätskan kokar leds ångan ned i förlaget där den kondensras. Denna anordning har alltså ingen egen kylare utan förlaget fungerar även som en kylanordning. Retorten var ett instrument som användes av alkemisterna och av kemisterna fram till 1800-talet.
Pot-still
Pot-still apparaten är den gamla klassiska destillationskannan och används
vid framställning av de ädla spritsorterna som whisky, cognac och
rom.
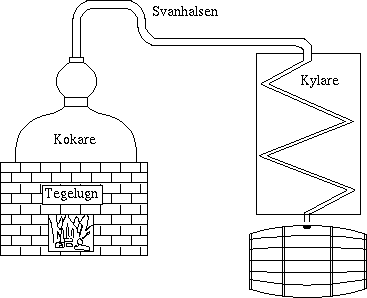
De är för det mesta gjorda av koppar och mycket vackra att titta
på. En typisk pot-still anordning för cognacdestillation är
uppbyggd enligt bilden. Den består av en kokare som vanligtvis är
inbyggd i en ved- eller koleldad tegelugn. Ångorna från kokaren
leds vidare via destillationshatten och "svanhalsen" till kylaren.
Kylaren består av en stor behållare med kylmedium som vanligtvis
är vatten. Ångorna leds ned i kylaren och in i ett spiralsystem
där ångorna kondenseras till vätska. Destillatet tappas ut
vid kylarens botten till ett uppsamlingskärl. Efter det kan destillatet
destilleras om eller lagras. Vissa cognacproducenter använder en specialvariant
av denna apparat där ångorna, innan de når själva kylaren, via rör leds
in i en behållare med vin som skall destilleras senare. I denna process blir
vinet som skall destilleras härnäst lite uppvärmt och detta
betyder att det inte behövs lika mycket energi för att värma
upp vinet vid destillationen eftersom det redan blivit lite uppvärmt.
På samma gång så blir ångan lite förkyld så
det behövs inte lika mycket kylmedium för att kondensera den.
Pot-still apparater i Skottland ser i stora drag ut som de i Cognac men med
små skillnader. De har inte lika utpräglad kula på destillationshatten.
I bland är kulan helt utjämnad så ångorna leds rakt
upp. Svanhalsen brukar heller inte vara så framträdande som de
i Cognac. Whiskeyproducenter i Skottland har vanligtvis sin egen lilla specialvariant
av pot-still som ger deras whisky en speciell karaktär, men rent
vetenskapligt är skillnaderna obetydliga.
Kolonnapparat Coffey
Kolonnapparaten eller Coffey-still är uppkallad efter Aeneas Coffey,
skotsk destillatör. Jämfört med en pot-still kan i en Coffey-still
destillation ske kontinuerligt, man behöver inte avbryta destillationen
och fylla på ny mäsk. Destillatet är också mycket renare
än destillat från en pot-still. Coffey-still varianter används
idag till framställning av vodka, gin, amerikansk whiskey, rom och grain
whisky.
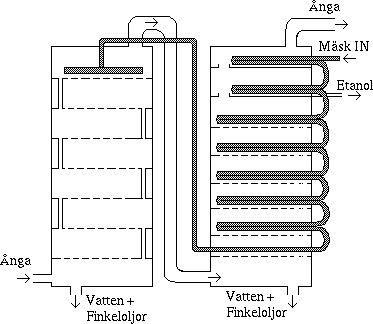
Bilden visar en typisk Coffey-still från patentet år 1832. Dagens
Coffey-stills fungerar fortfarande efter samma princip.
Den består av två parallella kolonner. Vid 'mäsk IN' fylls
mäsk på som sedan leds via rören till den vänstra kolonnen
där den droppar ut på bottnarna. Het ånga förs in vid
bottnen på den vänstra kolonnen som värmer upp mäsken.
Vatten, finkeloljor, mineraler och andra mäskbeståndsdelar transporteras
ut som vätska medan etanol- och vattenångor transporteras till
den högra kolonnen där ångan separeras ytterligare. Samtidigt
som ångan kyls värms mäsken upp. Eventuell vatten och finkel
transporteras ut via avloppet och lågkokande föroreningar (metanol,
acetaldehyd) transporteras ut via toppen på den högra kolonnen.
Etanolen som tappas ut har mycket hög renhet.
Kolonnapparat armagnac
Alambic armagnacais eller Alambic d'armagnac kallas den mycket speciella
destillationskanna som man destillerar armagnac ur. I princip är den
ganska lik pot-still apparaten, men den består även av en mindre
kolonn och den kan destillera kontinuerligt.
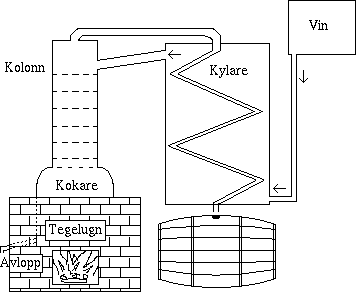
Vin från en behållare leds genom kylaren vidare till kolonnens
topp där den droppas ned till kokaren. Då ånga bildas leds
den genom kolonnen. Där tar den för utom etanol, även smak-
och aromämnen från vinet vilket ger armagnac dess speciella fruktiga
smak. Då ångan når kylaren kondenseras den och leds ner
till ett uppsamlingskärl för lagring.
Det speciella med denna destillationskanna är att vinet fungerar som
kylmedium vilket innebär att producenten återanvänder energi
eftersom kylmediumet värms upp då ångan kondenseras. En
annan intressant sak är att ångan som bildas i kokaren kommer
i kontakt med nytt vin i kolonnen hela tiden så destillatet blir väldigt
smakrikt och fruktigt. Kolonnen på denna apparat är relativt kort
så någon större separering sker inte, destillatet har vanligtvis
en alkoholhalt mellan 55-60(vol.)%.
Referenser
Atkins, P.W., Physical Chemistry 5th ed. 1995. Oxford University Press.
Hägg, Gunnar, Allmän och oorganisk kemi. 1966. Almqvist
& Wiksells.
Jackson, Michael. Stora boken om Whisky. 1987. Doring Kindersley.
Ray, Cyril. Alla dessa drycker. 1977. Wezäta Förlag.
Umland, Jean B. General Chemistry. 1993. West Publishing Company.
Wikland Sten, På butelj och fat 3:e uppl. 1967. P.A. Nordstedt
& Söner.
[Kents Spritskola]
Uppdaterad 2005-08-08
© Kent Persson 1996-2005
![]()