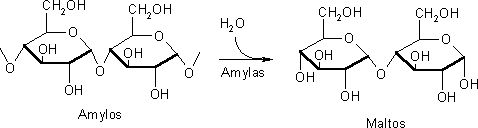
Introduktion
När man hör ordet jäsning tänker man främst på
jäsning i samband med brödbakning och om man är mer intresserad
av alkohol så tänker man kanske snarare på etanoljäsning. Men jäsning
kan vara mer än så. Strikt vetenskapligt definieras jäsning
som en anaerobisk process (en process som fortgår utan syre) där kemiska ämnen bryts ned under inverkan av mikroorganismer, t ex
jästsvampar, mögelsvampar, bakterier till mindre beståndsdelar. Det finns t ex smörsyrejäsning,
ättiksyrejäsning och mjölksyrejäsning som alla kan orsakas
av olika bakterier. Vinintresserade känner säkert till malolaktisk
jäsning som sker i vinet efter etanoljäsningen. I den malolaktiska
jäsningen omvandlas vinets skarpa och sura äpplesyra till mjuk
och fyllig mjölksyra under inverkan av bakterier.
I etanol- och brödexemplen ovan är jästsvamparna (saccharomyces
cerevisiae) mikroorganismerna, socker är det kemiska ämne som
bryts ned och koldioxid och etanol de produkter man är intresserade
av. Denna text kommer till största del att behandla etanoljäsningen.
Historia
Människan upptäckte, troligtvis av en slump, att druvsaft genomgick
en förändring då det förvarats en liten tid. Detta skedde
i nuvarande Iran för ca 7000 år sedan. På den tiden samt de efterföljande 6700 åren var man
ganska nöjd med att det bildades vin, man brydde sig inte om
hur det kunde bildas. Dåtidens människor uppfattade vinjäsningen som en reningsprocess
där bottensatsen, som huvudsakligen består av döda jästceller och
fasta beståndsdelar som funnits i musten, var orenheter som avsöndrats
från druvsaften och det kvarvarande vinet var den förädlade
druvsaften.
Under medeltiden kunde det orena dricksvattnet ge upphov till elakartade sjukdomar, men
samma vatten användes utan problem till ölbryggning och resulterade inte till några sjukdomar hos de som drack av ölet.
Denna högst anmärkningsvärda kvalitetsförbättring gjorde att jäsningen, för utom dess renande egenskaper, även
tillskrevs smått magiska och mystiska attribut. Idag vet man att bakterierna
i dricksvattnet dog i vörtningsprocessen när vattnet kokades.
Denna bild av jäsningen levde kvar en ganska lång
tid. Det var inte förrän på slutet av medeltiden vetenskapsmännen
och alkemisterna började undersöka jäsningen mer noggrant.
På den tiden gjorde alkemisterna inte någon större skillnad
mellan jäsning och en reaktion som sker under gasutveckling. Alkemisterna
ansåg att så vitt skilda reaktioner som metall i en syra (vätgasutveckling)
och alkoholjäsning (koldioxidutveckling) var likvärdiga eftersom det
bubblade. Gasutvecklingen orsakades enligt alkemisterna av en okänd
naturkraft som kallades "fermentum" från latinets fevere
som betyder sjuda eller jäsa. Jäsningsförloppet har sedan
början tolkats som ett helt mekaniskt förlopp, man hade ingen tanke
på att levande organismer kunde var inblandade.
Vid slutet av 1700-talet och framåt tog jäsningsforskningen ny
fart med bl a kemister som Lavoisier och Gay-Lussac. Gay-Lussac var den första
som framlade en summaformel för alkoholjäsningen
C6H12O6 = 2C2H5OH +
2CO2
och den person
som myntade det franska ordet "ferment". På 1830-talet föreslogs
från många håll att jäsningen skulle orsakas av levande
mikroorganismer som livnärde sig på socker och utsöndrade
koldioxid och etanol. Dessa teorier baserades sig på att buljong som
värmts till 100°C inte ruttnade om den förvarades i flaska
med luft som värmts i glödande rör. Liknande experiment med
sockerlösningar tydde också på det. Man antog att det var
något främmande ämne i luften som sönderdelades vid uppvärmningen och efter sönderdelningen omöjliggjordes jäsning. Vid mikroskopiska
undersökningar av jäst som isolerats från jäsande prover upptäcktes att den bestod av små
svampliknade växter. Ur dessa iakttagelser föddes "den vitalistiska
jäsningsteorin" (från lat. Vita=liv).
Denna teori förkastades omedelbart av kemisterna eftersom det skulle
innebära, enligt Liebig, att en organism under loppet av 18 timmar skulle
producera 66 gånger sin egen vikt av etanol. Liebig drog slutsatsen
att ingen levande organism skulle kunna producera 66 gånger sin egen
vikt i exkrementer. Den kända tyska kemisten Wöhler skickade även
en karikatyrbild till en tysk kemisk tidsskrift som förlöjligade
vitalisternas teori. Bilden föreställde en jästsvamp, formad
som en destillationskolv som åt socker och bajsade etanol samtidigt
som njurarna utsöndrade koldioxid.
På 1850-talet kontrade vitalisten Louis Pasteur med experiment som
visade att jäsningen uteblir om man hindrar jästcellerna att komma
i kontakt med sockerlösningen. Pasteur menade att jäsningen var
knuten till jästsvampens liv, men hur jästsvamparna verkade kunde
han inte förklara.
Ungefär samtidigt som jästsvampsgrälet pågick i den
akademiska världen gjordes även framsteg inom enzymkemin, bl a
pepsin, ett enzym som bryter ned protein, upptäcktes. I samband med
det så presenterades en teori om att jäsningen skulle vara ett
resultat av enzymers verkan. Beviset för att det är på det
viset presenterades 1897 av Eduard Buchner (1860-1917, Buchner stupade under första världskriget) då han visade
att filtrerad "jästsaft" från pressad jäst kunde
omvandla socker till etanol lika bra som jästsvampar. Detta experiment
innebar Nobelpris till Buchner (1907) och även sista spiken i kistan för
den vitalistiska jäsningsteorin.
Jästsvampar
Familjen jästsvampar (saccharomycetaceae) ur klassen säcksporsvampar
(ascomycetes) är encelliga mikroskopiska organismer. Det finns
ca 500 olika arter av jästsvampar men de som är intressanta från
alkoholsynpunkt tillhör släkten saccharomyces ("sockerätande
svampar"), speciellt är arten saccharomyces cerevisiae (bagerijäst,
öljäst, cerevisia betyder öl på latin) intressant.
S. cerevisiae är inte så kräsen av sig. De kan inte
ta till vara på soljus som växter utan får sin energi genom att
bryta ned organiska molekyler, t ex socker, som finns i omgivningen.
S. cerevisiae förökar inte sig genom delning som bakterier,
utan de förökar sig genom knoppning, d v s från huvudcellen
bildas en liten knopp eller utbuktning. Knoppen växer sedan och när
den blivit lika stor som huvudcellen delas cellkärnan mellan huvudcellen
och knoppen. Efter detta separerar knoppen från cellen och en ny jästcell
har bildats.
Då S. cerevisiae dör genomgår de autolys, cellens
egna enzym börjar bryta ned cellen till enklare beståndsdelar.
Detta brukar resultera i en ganska äcklig doft som kan förstöra
en vin- eller öljäsning.
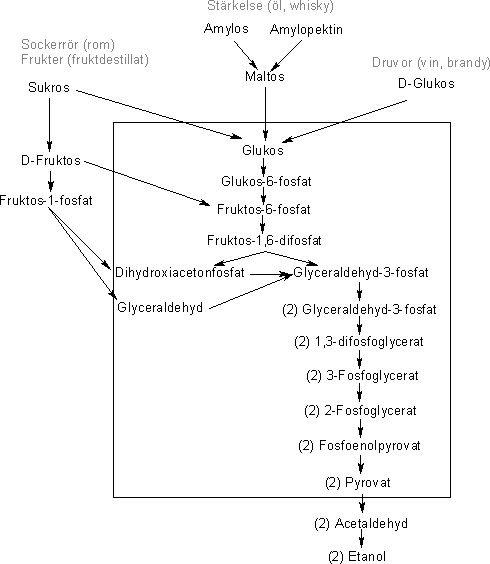
Glykolys
Glykolysen (från gr. Glykos = söt och lysis = klyvning) kallas
den enzymkatalyserade reaktionsserie som i tio steg bryter ned D-glukos (druvsocker) till
två ekvivalenter pyrovat. Glykolysen är nästan en universell
reaktionsserie, de flesta djur, svampar och vissa vattenlevande växter
kan bryta ned hexoser och utvinna energi. Glykolysens reaktioner sker i cellplasman.
Utgångsämnet är hexosen D-glukos. D-glukos finns naturligt
i många frukter och bär så vid vintillverkning behöver
druvorna inte genomgå någon förbehandling. Vid whisky- och
öltillverkning är D-glukos bundet i form av amylos och amylopektin.
För att frigöra D-glukos måste kornen genomgå en mätningsprocess
där amylos och amylopektin bryts ned under inverkan av enzymet amylas
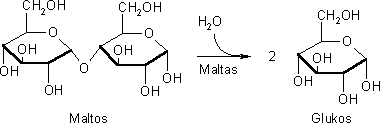
till maltos, som sedan hydrolyseras under inverkan av enzymet maltas till
D-glukos.
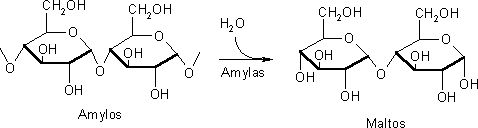
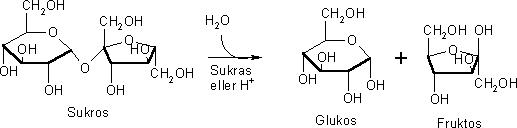
Vid romframställning där sockerråvaran är sukros (rörsocker) måste sukrosen hydrolyseras till D-glukos och D-fruktos. Denna hydrolys kan ske med hjälp av enzymet sukras men hydrolysen sker även spontant i en svagt sur vattenlösning. En blandning av D-glukos och D-fruktos kallas även för invertos.
Steg 1, fosforylering av D-glukos.
I glykolysens första steg sker fosforylering av D-glukos under inverkan
av enzymet hexokinas:
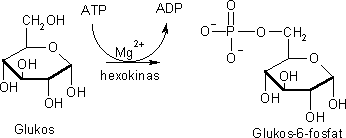
I reaktionen behöver även hexokinasenzymet en magnesiumjon som
katalysator. Steget kan ses som att glykosmolekylen förbereds för de kommande stegen genom att
hänga på en fosfatgrupp på molekylen. En molekyl ATP konsumeras även i reaktionssteget. Produkten kallas glukos-6-fosfat.
ATP är en förkortning av Adenosine triphosphate, en "standardiserad
energimolekyl" som fyller en mycket viktig roll som energitransportör
i organismer. ATP fungerar i princip som en hårdvaluta mellan celler i organismer.
ADP är en förkortning av Adenosine diphosphate, dvs en ATP som avgett en fosfatgrupp. ADP innehåller inte lika mycket energi som en ATP.
Steg 2, omvandling av glukos-6-fosfat.
I glykolysens andra steg konverteras glukos-6-fosfat, en fosforylerad aldos, till fruktos-6-fosfat,
en fosforylerad ketos, under inverkan av enzymet fosfohexasisomeras.
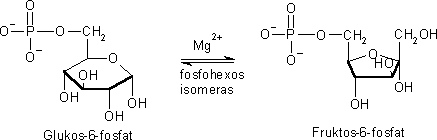
Fosfohexosisomeras behöver, liksom hexokinas, magnesiumjoner för
sin uppgift. Observera att denna reaktion är reversibel, d v s den kan
gå åt båda hållen.
Produkten fruktos-6-fosfat kan även erhållas ur motsvarande fosforylering av fruktos så
fruktos kan gå in i glykolysen vid steg två.
Steg 3, fosforylering av fruktos-6-fosfat.
I steg tre sker ytterligare en fosforylering under inverkan av enzymet fosfofruktokinas.
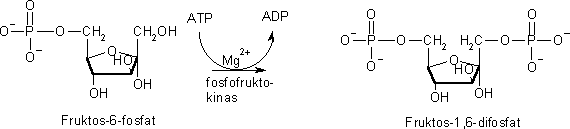
Fruktos-6-fosfat bildar fruktos-1,6-difosfat. Även här konsumeras en ATP och magnesiumjoner behövs för kinasets funktion. Detta irreversibla steg är mycket kraftigt beroende av tillgången på ATP. Om det finns riklig tillgång på ATP hämmas kinasenzymets funktion. Om det däremot skulle finnas mycket ADP kommer kinasenzymet istället att aktiveras.
Steg 4. klyvning av fruktos-1,6-difosfat.
I det fjärde steget klyvs fruktos-1,6-difosfat till en dihydroxiactetonfosfat
och en glyceraldehydfosfat.
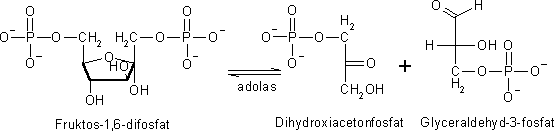
Reaktionen katalyseras av enzymet aldolas. Notera att de båda produkterna är enkla fosforylerade trioser, dihydroxiactetonfosfat är en fosforylerad ketos och glyceraldehydfosfat är en foforylerad aldos.
Steg 5, omvandling av trioser.
I steg nummer fem omvandlas produkterna från steg fyra under inverkan
av enzymet triosfosfatisomeras.
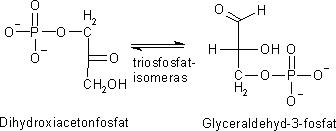
Reaktionen är reversibel men det är glyceraldehydfosfat som är
den användbara produkten. Eftersom den konsumeras i nästa steg,
förskjuts jämvikten åt höger.
Detta steg avslutar den förberedande och energikrävande delen av glykolysen. Följande fem steg
kallas för payoff phase på engelska och det är i payoff phase som organismen utvinner energi från glukos i form av ATP.
Steg 6, oxidation av glyceraldehyd-3-fosfat.
I steg nummer sex oxideras glyceraldehydfosfat till 1,3-difosforglycerat under
inverkan av enzymet glyceraldehyd-3-fosfatdehydrogenas och koenzymet NAD.
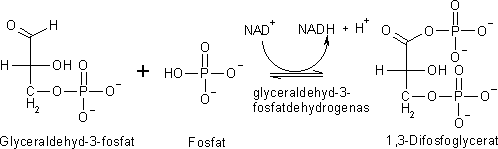
I reaktionen reagerar glyceraldehydfosfat med oorganiskt fosfat. I reaktionen bildas även
NADH och en vätejon. NAD är en förkortning av nikotinamide adenine dinukleotide, ett mycket viktigt
och mycket användbart koenzym som finns i alla organismer. Dess funktion är att transportera
väte (hydridjoner) till och från olika delar av cellen. NADH/NAD+ brukar i svenska biokemiböcker kallas för vätebärare.
Den inblandad i nästa alla biologiska reduktion-oxidation reaktioner där ett
dehydrogenasenzym är inblandat.
NAD+ och NADH är ganska stora molekyler och finns bara i begränsade mängder och för att
glykolysen skall kunna fortgå måste det NADH som bildas omvandlas till NAD+. Om det av en händelse
skulle råda brist på NAD+ kommer glykolysen att avstanna men det finns en hel del mekanismer för organismer att bilda NAD+ ur NADH.
Steg 7, fosfattransport till ADP
I glykolysens sjunde steg överförs, under inverkan av enzymet fosfoglyceratkinas,
energirik fosfat från 1,3-difosfoglycerat till en ADP och bildar en ATP.
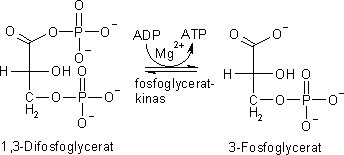
Den nya produkten heter 3-fosfoglycerat. Som med alla reaktioner som involverar ett kinas behövs magnesiumjoner för att katalysera reaktionen. I denna reaktion återfås två ATP (energimolekyler) som investerades i steg 1 och 3.
Steg 8, omvandling av 3-fosfoglycerat.
I det åttonde steget omvandlas 3-fosfoglycerat till 2-fosfoglycerat.
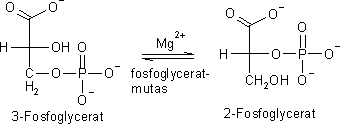
Enzymet fosfogyceratmutas katalyserar denna reversibla reaktion som även behöver magnesiumjoner.
Steg 9, dehydrering av 2-fosfogycerat.
I den nionde reaktionen genomgår 2-fosfogycerat en dehydrering till
fosfoenolpyrovat.
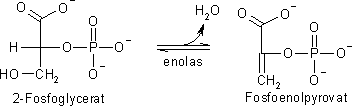
Denna reversibla reaktion katalyseras av enzymet enolas.
Steg 10, fosfattransport till ADP
I glykolysens tionde och sista reaktionssteg bildas så pyrovat ur fosfoenolpyrovat.
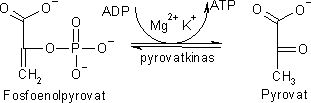
Reaktionen katalyseras av pyrovatkinas med hjälp av mineralen magnesium och kalium. Här bildas även energi i form av ATP.
Sammanfattning av de tio stegen
Sammanfattar man hela glykolysen så får man:
Glukos+2NAD++2ADP+2fosfat = 2 pyrovat+2NADH+2H++2ATP+2H2O
Så från organismens synvinkel har den brutit ned en glukosmolekyl
till 2 pyrovatmolekyler och samtidigt fått två ATP (energi) och
2NADH (användbart koenzym).
För att glykolysen skall ske så smidigt som möjligt under en alkoholjäsning behöver jästsvamparna tillgång till
mineraler i form av magnesium-, kalium- och fosfatjoner.
Pyrovatets och NADH:s användning.
För organismer är pyrovat mycket användbart. Det kan t ex
användas till att tillverka aminosyror som sedan används till att
tillverka proteiner. Men det absolut vanligaste användningsområdet
är att det förbränns i en reaktionscykel som kallas citronsyracykeln.
Där bildas koldioxid, energi och fler NADH-molekyler.
De NADH-molekyler som bl a bildas i glykolysen och citronsyracykeln omsätts, om det finns syre tillgängligt,
i en process som kallas cellandningen. I cellandningen reagerar NADH, vätejoner och syre med varandra och bildar vatten och ATP-molekyler.
En NADH-molekyl ger tre ATP-molekyler i cellandningen.
Om syre av en händelse inte skulle finnas tillgängligt kommer NADH-molekyler att ansamlas
i organismen och detta leder i sin tur till att glykolysen avstannar och att ATP-produktionen upphör. En
organism som inte kan utvinna energi kommer så småningom att dö. För att överleva
måste alltså organismen omsätta pyrovat och NADH
på ett annat sätt. I naturen finns lyckligtvis flera olika sätt att
omsätta NADH vid syrebrist, eller under anaerobiska förhållanden som det även heter
(an = nekande förstavelse, aer = luft), bl a mjölksyrejäsning och
alkoholjäsning.
Mjölksyrejäsning
Vid mjölksyrejäsning reduceras pyrovat med NADH under inverkan
av enzymet laktatdehydrogenas och bildar laktat (mjölksyra).
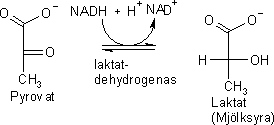
I reaktionen bildas NAD+ som kan användas i glykolysens steg 6 som sedan
leder till att mer energi i form av ATP bildas. Jästsvampar (Saccharomyces spp.) producerar inte
mjölksyra utan eventuell mjölksyra i vin, öl och mäsk är resultat av bakterier. Det är därför
mycket viktigt att sterilisera utrustningen innan jäsningen påbörjas och att
döda eventuella främmande mikroorganismer på druvorna med svaveldioxid.
Mjölksyrajäsningen
kan ses som en nödlösning för organismer då det råder
syrebrist. Vi människor producerar mjölksyra i muskelcellerna då
vi utför något intensivt kroppsarbete (syrebrist i musklerna)
helt enligt reaktionen ovan.
Etanoljäsning
Andra organismer, t ex jästceller, har löst syrebristproblemet
på ett helt annat sätt. Vid syrebrist tillverkar de acetaldehyd
ur pyrovat och i nästa steg reduceras acetaldehyden till etanol.
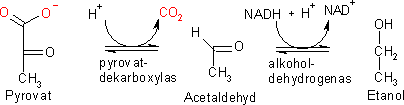
Reaktionerna katalyseras av pyrovatdekarboxylas tillsammans med magnesiumjoner
och TPP (thiamine pyrophophate, ett koenzym) och enzymet alkoholdehydrogenas.
Helt analogt med mjölksyrejäsningen bildas NAD+ i reduktionen.
Etanoljäsningen är liksom mjölksyrejäsningen en nödlösning som organismer använder så det råder syrebrist.
Under en etanoljäsning är det viktigt att mäsken inte utsätts för syre, annars bildas ingen etanol.
Glykolys, en översikt
Etanolytbyte
Rent teoretiskt borde glykolysen och aldehydreduktionen ge utbytet 51,1% etanol och 48,9% koldioxid.
Ett kilogram rörsocker ger under helt teoretiskt ideala omständigheter 538,2g etanol motsvarande 700ml 96% etanol och
514,8g koldioxid motsvarande 290 liter koldioxid vid 25°C. I verkligheten är utbytet alls så stort utan bör ligga
runt 48% för etanol och 47% för koldioxid beroende på vilka omständigheter som råder under jäsningen (Amerine 1972).
Orsakerna till detta är, förutom det helt uppenbara att etanol avdunstar under jäsningen, att det även sker även en
del sidoreaktioner i glykolysen som ger andra slutprodukter än etanol.
Sidoreaktioner till etanoljäsningen
Förutom de icke önskvärda produkterna mjölksyra och acetaldehyd som togs upp ovan så sker
även en del andra reaktioner som inte är önskvärda.
Som även nämndes ovan så är pyrovat ett mycket användbart ämne för organismer
så en del pyrovat kan ha använts till att framställa andra, för jästsvampen livsviktiga, ämnen som exempelvis proteiner.
Ättiksyrejäsning
Acetaldehyd som bildas efter pyrovatets dekarboxylering kan även oxideras till
acetat eller ättiksyra.
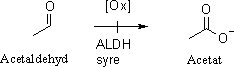
Acetat bildas främst om det finns mycket syre tillgängligt samt om det finns bakterier i mäsken. Enzymet som katalyserar aldehyd heter aldehyddegydrogenas (ALDH) och är det samma enzym som bryter ner aldehyd i människokroppen.
Glyceroljäsning
En av produkterna i glykolysens fjärde steg, dihydroxiactetonfosfat, kan omvandlas
till glycerol.
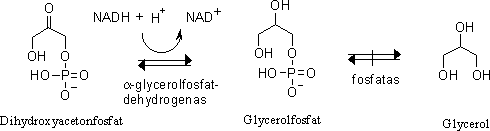
Dihydroxiacetonfosfat dehydreras under inverkan av enzymet alfa-glycerolfofatdehydrogenas.
I steget därpå avlägsnas fosfatgruppen och glycerol bildas. I denna reaktion frigörs
NAD+, precis som i etanolbildnigen, vilket innebär att denna
glycerolbildning kan konkurrera med etanolbildningen.
Måttlig glycerolbildning i samband med vinjäsning kan i vissa fall vara ganska uppskattat eftersom det ger en
lite fyllig sötma till vinet.
Andra produkter av jäsningen
Finkeloljor
Huvudbeståndsdelarna i finkelolja utgörs av de högre alkoholerna 2-metyl-1-butanol, 3-metyl-1-butanol
(båda alkoholerna utgör ca 50-80%) och 2-metylpropanol (isobutanol, ca 20-30%). Dessa tre alkoholer utgör
vanligtvis 90% av all finkelolja. Finkeloljorna är inte någon
sidoprodukt av glykolysen men de bildas parallellt under jäsningen efter andra mekanismer.
Finkeloljorna bildas inte ur kolhydraterna som etanol gör utan de bildas ur aminosyror
som sönderdelas enligt en mekanism som kallas Ehrlichmekanismen (Ehrlich pathway).
Det finns även experimentella försök som tyder på att finkeloljorna bildas ur aminosyror:
1. Stereokemin hos 2-metyl-1-butanol och isoleucin är bevarad. 2-metylgruppen har samma riktning i rummet.
2. Tillsätter man aminosyrorna valin, leucin och isoleucin till mäsk ökar produktionen av motsvarande finkeloljor (Kodama 2001).
3. Mäter man koncentrationerna av aminosyrorna valin, leucin och isoleucin samt koncentratioerna av finkeloljorna ser man
att koncentrationerna av aminosyrorna minskar samtidigt som koncentrationen av motsvarande finkeloljor ökar (Schure 1998, Kodama 2001).
Att Ehrlichmekanismen, som presenterades redan 1907, skulle vara orsaken till att det bildas högre alkoholer under jäsning
är en allmänt accepterad idé.
Idag pågår det forskning, bl a på olika bryggerier, för att
komma på något sätt att minska produktionen av finkeloljorna under jäsningen.
Ehrlichmekanismen sker i stora drag enligt figuren:
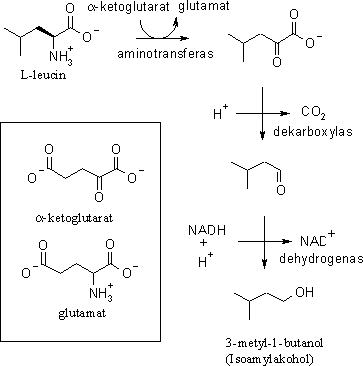
En aminosyra (i detta fall leucin) transamineras, aminogruppen ersätts med en syreatom.
I reaktionen utgör 2-ketoglutarat och L-glutamin syre- respektive aminotransportörer. I efterföljande steg
sker en dekarboxylering, en koldioxidmolekyl "plockas bort" från molekylen. I det sista steget sker
en dehydrogenering, helt analogt med dehydrogeneringen som bildar etanol, och alkoholen, 3-metyl-1-butanol, bildas.
Helt analogt genomgår aminosyrorna isoleucin
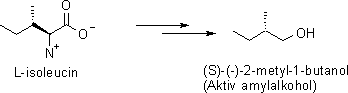
och valin
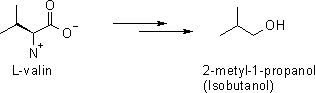
liknande processer och bildar 2-metyl-1-butanol och 2-metyl-1-propanol.
Ur jästsvampens synvinkel är Ehrlichmekanismen i själva verket ett sätt
att utvinna kväve ur omgivningen samt ytterligare en metod att omvandla NADH som bildades under glykolysen till NAD+.
De finkeloljor som bildas i är bara
biprodukter från denna process. Det går att minska produktionen av finkeloljor
genom att förse jästsvamparna med en alternativ kvävekälla, t ex
genom att tillsätta ammoniak eller hjorthornssalt till mäsken innan
jäsningen.
Metanol
En ganska vanlig förorening i spritdrycker är metanol. I ren form är metanol giftigt men
i små mängder kan den orsaka huvudvärk och illamående.
Med utgång från informationen i ovanstående stycke är det lätt att tro att metanol, liksom
de andra inte önskvärda alkoholerna, blidas ur någon aminosyra, t ex glycin, via Ehrlichmekanismen enligt:
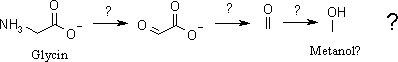
Men det stämmer inte. Ovanstående reaktion är inte den största källan till metanol i spritdrycker. Det är tveksamt om den överhuvudtaget bidrar med någon metanol alls. Den största källan till metanol i spritdrycker är i stället hydrolys av pektinämnen enligt följande reaktion.
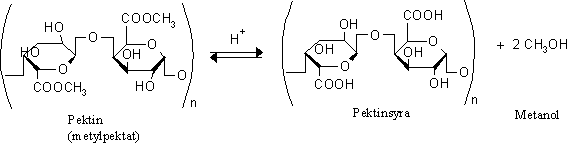
Reaktionen är en helt vanlig esterhydrolys.
Pektin är ett sockerpolymer som finns naturligt i så gott som alla frukter,
bär och rotfrukter. Det fyller en mycket viktig funktion som ett klister som håller ihop fruktcellerna och gör frukten fast.
Slanggurkor innehåller procentuellt lika mycket vatten som havsvatten men
lyckas ändå behålla en fast form tack vare pektin. Rent pektin används
ibland vid syltning och vid framställning av geléer eftersom pektin gelatineras
då det värms.
Vid vinframställning är däremot pektin en gissel. Vin som inte behandlats med
pektinnedbrytande enzymer bildar ofta en ful och osmaklig pektindimma som gör vinet grumligt
och oaptitligt.
Rent kemiskt består pektin av olika sockerpolymerer, men den viktigaste av dessa
är metylpektat som består av metylgalaktonatpolymerer (galaktonsyrans metylester,
galaktonsyra är hexosen galaktos som oxiderats till syra). Då metylpektat
sönderdelas hydrolyseras esterbindningarna och galaktonsyra och metanol bildas. Galaktonsyran kan
via några reaktioner gå in i glykolysen och bilda etanol men metanolen blir kvar i vinet/mäsken.
Referenser
Svensk Uppslagsbok: jäsning, jästsvampar
Bolin, Iwan., Gustaver, Bror. Den Organiska Kemien 1965, Liber.
Noodapera, Mikk., En liten bok om öl, 1993, Informationsfölaget.
Amerine, Berg, Cruess, The Technology of Wine Making 3rd ed., 1972 AVI.
Lehninger, A.L., Nelson, D.L., Cox, M.M. Principles of Biochemistry 2nd ed.1993 Worth Publishers.
McMurry J. Organic Chemistry 4th ed., 1995 Brooks/Cole Publishing.
Willstaedt, Virgin, Myrbäck, Kemi med biokemi, 1965, Bonniers.
Schure et al. 1998 Appl. Environ. Microbiol. 64(4):1303-1307.
Kodama, Omura, Miyajima, Ashikari, 2001 J. Am. Soc. Brew. Chem. 59(4):157-162.
[Kents Spritskola]
Uppdaterad 2005-08-08
© Kent Persson 2001-2005
![]()