Volymprocent vs. viktprocent
Etanolhalten eller alkoholstyrkan för vätskor avsedda för
invärtes bruk anges för det mesta i procent, menat hur många hundradelar
av blandningen som består av ren etanol i förhållande till
vatten. Av en konstig anledning används uteslutande volymprocent för
att ange etanolhalten för drycken. Att bruka volymprocent i stället
för viktprocent är komplicerat av två stora anledningar.
1. Etanol och vatten minskar i volym då de blandas, t.
ex. blandas vid 25°C 5 liter ren etanol med 5 liter vatten erhålles
inte 10 liter 50 vol.% etanol-vatten blandning utan 9,65 liter 51,7 vol.%
etanol/vatten blandning. Detta beror på att de partiella molära
volymerna för etanol (ökar) och vatten (minskar) ändras då
de blandas. Man kan säga att blandningen molekylerna använder vätskans
utrymme mer effektivt då de är i blandning.
Fenomenet kan jämföras med följande analogi. Låt oss
säga att vi har två spannar. Den ena spannen är halvfull
med golfbollar och den andra är halvfull med små blyhagel. Rent
volymmässigt har vi två halva spannar och hälls innehållet
från den ena spannen till den andra så borde vi fä en helt
full spann med boll/hagel blandning. Men detta är fel. Skulle vi utföra
detta rent praktiskt så kommer blyhaglen att utnyttja mellanrummen
mellan de relativt stora golfbollarna och den totala volymen av boll/hagel
blandningen kommer att bli mindre är den hela spannen som vi resonerade
fram innan.
2. Den andra anledningen till att viktprocent är att föredra är att volymen hos etanol och vatten ändras vid olika temperaturer. Detta gäller mer eller mindre alla ämnen. För att komplicera det ytterligare så ändras volymen hos etanol och vatten olika mycket vid en temperaturförändring, t ex blandas 5 liter ren etanol med 5 liter vatten erhålles vid 0°C; 9,59 liter 52,3 vol.% blandning, vid 25°C; 9,65 liter 51,7 vol. % blandning och vid 50°C erhålles 9,67 liter 51,3 vol%. Skulle man i stället göra samma sak med avseende på massa, dvs 5 kg etanol blandas med 5 kg vatten, erhålles 10 kg 50 vikt% etanol-vattenblandning och detta är oberoende av temperatur.
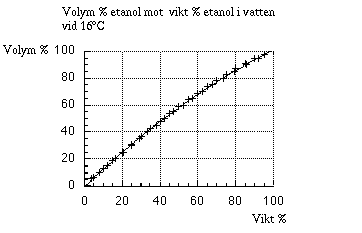
Förutom ovanstående orsaker är konverteringen mellan vikt%
och volym% inte linjär, vilket framgår i nedanstående figur.

Ur figuren ser man att viktprocent och volymprocent är lika endast vid 0% och 100%. Skillnaden mellan viktprocent och volymprocent är störst vid 50 vikt% (=58,8 vol.%). Det går alltså inte ta volymprocent och multiplicera det med ett tal och erhålla viktprocent. I följande tabell finns vol.% etanol mot motsvarande vikt% och vice versa vid 16°C, samt motsvarande etanolkoncentration i mol/(dm)3.
| c/vol.%* | c/vikt%* | c/M** | c/vikt%* | c/vol.%* | c/M** | |
| 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | |
| 5,00 | 4,00 | 0,690 | 5,00 | 6,25 | 1,08 | |
| 10,00 | 8,05 | 1,38 | 10,00 | 12,42 | 2,14 | |
| 15,00 | 12,15 | 2,58 | 15,00 | 18,52 | 3,18 | |
| 20,00 | 16,28 | 3,44 | 20,00 | 24,57 | 4,22 | |
| 25,00 | 20,46 | 4,31 | 25,00 | 30,55 | 5,24 | |
| 30,00 | 24,69 | 5,17 | 30,00 | 36,45 | 6,24 | |
| 35,00 | 28,99 | 6,03 | 35,00 | 42,25 | 7,21 | |
| 40,00 | 33,39 | 6,89 | 40,00 | 47,92 | 8,16 | |
| 45,00 | 37,90 | 7,75 | 45,00 | 53,48 | 9,08 | |
| 50,00 | 42,52 | 8,61 | 50,00 | 58,79 | 9,97 | |
| 55,00 | 47,29 | 9,49 | 55,00 | 63,97 | 10,83 | |
| 60,00 | 52,20 | 10,35 | 60,00 | 68,97 | 11,67 | |
| 65,00 | 57,25 | 11,21 | 65,00 | 73,79 | 12,48 | |
| 70,00 | 62,51 | 12,08 | 70,00 | 78,40 | 13,26 | |
| 75,00 | 67,93 | 12,94 | 75,00 | 82,80 | 14,01 | |
| 80,00 | 73,59 | 13,80 | 80,00 | 86,97 | 14,73 | |
| 85,00 | 79,50 | 14,66 | 85,00 | 90,88 | 15,42 | |
| 90,00 | 85,75 | 15,52 | 90,00 | 94,46 | 16,08 | |
| 95,00 | 92,46 | 16,38 | 95,00 | 97,61 | 16,69 | |
| 100,0 | 100,0 | 17,23 | 100,0 | 100,0 | 17,23 | |
Gäller vid 15,56°C (=60°F) | ||||||
Andra enheter för alkoholstyrka
En annan styrkeangivelse för etanolhaltiga drycker är enheten
proof som är mycket vanlig speciellt på amerikanska spritflaskor. Proof
är en ganska gammal enhet som användes förr och
det bestämdes genom att undersöka om svartkrut som fuktats med sprit kunde antändas,
för att på så sätt få proof (bevis) på spritens styrka.
Den lägsta alkoholkoncentration som behövdes för att antända blandningen var vid
16°C (60°F) 57,1 (vol.)%. Denna sprit kallades då 100°proof.
I USA är spriten 100°proof vid 50 (vol.)%, så brittiska och amerikanska proof skiljer sig lite.
Exempelvis är den vanliga styrkan 40 (vol.)% i USA 80°proof och i Storbritannien 70°proof.
I Kanada förekom en annan sort proof som påminde om den engelska. I den kanadensiska
var spriten proof vid 100° brittiska proof. Varje grad över proof kallades
då overprof, t.ex. 125° br. proof var 25° OP (over proof) i Kanada. På
samma sätt var 75° br. proof 25°UP (under proof) i Kanada.
I Frankrike används sk. Gay-Lussac grader, som faktiskt är det samma som volymprocent.
40° på en fransk spritflaska betyder inget annat än 40 (vol.)%.
Frankrike och Storbritannien använder officiellt volymprocent sedan EU-inträdet men USA använder fortfarande
proof på sina spritflaskor. På amerikanska spritflaskor och på europeiska spritflaskor som är avsedda för export
anges alkoholstyrkan vanligtvis med proof och volymprocent.
För att omvandla amerikanska proof till volymprocent behöver man bara dividera med 2, så 80 proof
är 80/2=40 (vol.)%.
| vol.% | br. proof | US proof | kan. proof |
| 0 | 0 | 0 | 100 UP |
| 14 | 25 | 28 | 75 UP |
| 29 | 50 | 58 | 50 UP |
| 40 | 70 | 80 | 30 UP |
| 43 | 75 | 86 | 25 UP |
| 50 | 87 | 100 | 13 UP |
| 57,1 | 100 | 114 | Proof |
| 71,5 | 125 | 143 | 25 OP |
| 86 | 150 | 172 | 50 OP |
| 100 | 175 | 200 | 75 OP |
96% etanol
Den högsta etanolhalt som kan uppnås genom destillering är
96(vol.)%, egentligen 95,6(vol.)%. Detta beror på att en 96% blandning
etanol och vatten har en lägre kokpunkt (78,15°C) än ren etanol
(78,3°C).
Destillerar man en etanol/vatten blandning så värms först
blandningen upp och ånga bestående av etanol och vatten bildas.
Ångan kommer att ha en högre halt etanol än vätskan
den kommer i från och så länge etanolhalten i ångan
är högre än etanolhalten i vätskan är destillering
möjlig. Destillerar man en vätska med sammansättningen 95,6 vol.%
etanol, kommer ångan och vätskan att ha samma sammansättning
och destillering är inte längre möjlig. Man säger att
etanol och vatten bildar en azeotrop.
Vill man ha högre koncentration på etanolen måste den renas
på ett annat sätt, vanligtvis genom att tillsätta ett vattenabsorberande
ämne som t ex kalciumoxid (bränt kalk) och sedan destillera
spriten igen.
Det är även möjligt att sänka trycket vid destillationen,
så kallad vakuumdestillering. Sänkes trycket till 95mmHg (12,7kPa,
0,125 atm) bildar vatten och etanol azeotrop vid 99,5 vol.% etanol.
Så kallad absolut alkohol/etanol (förväxla ej med varumärket
Absolut!) har en etanolhalt på minst 99,5(vol.)%. Etanol i så
höga koncentrationer absorberar mycket gärna vatten i från
omgivningen, t o m från luften. Sådan sprit används
i karburatorsprit som hälls i bensintanken för att bli kvitt vatten
som finns i bensinen.
Denaturering
Ordet denaturera kommer i från franska denature och är en sammanslagning
av den nekande förstavelsen de- och nature. Denaturera betyder alltså
"att göra onaturlig", vilket i detta sammanhang innebär
att tillsätter flera ämnen med icke så angenäma lukt
och smak egenskaper. T-Röd innehåller bl. a. ett rött färgämne
så att spriten inte förväxlas med andra rengöringsmedel
eller drycker. Vidare innehåller ett ämne, kallat bittrex***, som
ger en mycket obehaglig, kraftig bitter smak. T-röd kan även innehålla
2-butanon (metyletylketon), en keton vars smak och lukt påminner om
aceton dvs inte allt för ljuvlig. Det finurliga med 2-butanon
är att dess kokpunkt, 79,5°C, är ungefär densamma som
etanols (78,5°C) så destillering av T-Röd blir alltså
mycket komplicerad, svår och i praktiken omöjlig att utföra i mindre skala.
T-röd innehåller inte betydande mängder metanol (träsprit).
Hade så varit fallet hade det, enligt svensk lag, stått på
varningsetiketten klart och tydligt, vilket det inte gör.
Anledningen till att man denaturerar viss etanol är att Sverige och
många andra länder har olika skatter på etanol till förtäring
och etanol till förbränning / rengöring. Etanol till förtäring
brukar ha högre skatt än rengörings / förbrännings
etanol.
*** Kemister föredrar kanske det korrekta IUPAC-namnet:
N-[(2-[2,6-dimetylfenyl)amino]-2-oxoetyl]-N,N-dietylbensenmetanaminiumbensonat,
(CAS-RN: 3734-33-6). Summaformel: C28H34N2O3.
[Kents Spritskola]
Uppdaterad 2005-08-08
© Kent Persson 1996-2005
![]()